T细胞急性淋巴细胞白血病 (T-ALL) 是一种侵袭性血液恶性肿瘤,其中约有75%的病例是由Notch1基因突变导致的,因此Notch1的抑制剂GSI常被用作该病的靶向用药。然而,临床上常出现原发性耐药或复发性耐药,这大大限制了GSI作为T-ALL靶向用药的临床效果。 2021年5月丹麦哥本哈根大学Jesper V. Olsen团队在Nature Communications(IF:14.919)杂志上发表题为 《Proteomics of resistance to Notch1 inhibition in acute lymphoblastic leukemia reveals targetable kinase signatures》的研究成果,利用蛋白组和DIA磷酸化修饰蛋白组找到了不同耐药细胞共同的特征和新的药物靶点。 【研究材料】 1. 固有耐药模型:对GSI药物具有固有耐药的3种细胞系JURKAT、MOLT-3、PEER,药物敏感的3种细胞系DND-41、HBP-ALL、ALL-SIL; 2. 获得性耐药模型I:从药物敏感细胞系DND-41中筛选获得性耐药细胞株(persister cells); 3. 获得性耐药模型II:从两例临床患者中分离到药物敏感癌细胞系,利用PDX(patient-derived xenografts)小鼠模型筛选获得性耐药细胞株。 【技术方法】 蛋白组、DIA磷酸化修饰蛋白组 🔹 步骤1:建立3种GSI耐药模型,采用蛋白组和DIA磷酸化组分析分子水平变化; 🔹 步骤2:分析GSI固有耐药模型的分子变化特征; 🔹 步骤3:分析GSI获得性耐药模型的分子变化特征; 🔹 步骤4:寻找模型间的耐药调控共性,激酶底物分析找到关键激酶PKC,验证其调控机制; 🔹 步骤5:以PKC为新靶点,探讨与Notch1抑制剂联合用药的效果。 1. 建立GSI耐药模型 为了探索T-ALL癌细胞对GSI产生固有耐药(Intrinsic resistance)和获得性耐药(acquired resistance)是否有共同的分子基础,研究者建立了三种GSI耐药模型。固有耐药模型比较了耐药细胞系JURKAT、MOLT-3、PEER和药敏细胞系DND-41、HBP-ALL、ALL-SIL。获得性耐药采用了两种模型,第一种模型是利用敏感细胞系DND-41筛选获得性耐药细胞株(persister cells),第二种模型是从两例临床患者中分离到药物敏感癌细胞系,利用PDX小鼠模型筛选获得性耐药细胞株。研究者利用蛋白组学和DIA磷酸化修饰蛋白组学分析了三种模型的分子应答异同。 图1 GSI固有耐药模型和获得性耐药模型的组学分析流程 2. GSI药物固有耐药模型中的分子调控特征 GSI药物敏感细胞系和耐药细胞系的蛋白表达模式存在显著不同,共发现596个差异表达蛋白,其中323个蛋白在耐药细胞系中表达丰度更高。结合转录调控数据库ChEA发现,这些差异蛋白存在两个调控簇,预测其主调控因子分别是Notch1和Tal1。 GO富集分析发现,差异蛋白功能主要集中在氨基酸代谢、脂肪酸降解、活性氧清除等过程。将差异蛋白在药物响应数据库CMap比对发现,细胞对GSI药物敏感性应答与蛋白合成抑制剂伊米丁和mTOR抑制剂的表达特征相似性最高。与之相契合的是,在磷酸化修饰组中差异修饰的蛋白功能也显著富集了mTOR信号传导和蛋白翻译调控等途径。这表明,癌细胞对GSI的耐药性可能通过抑制mTOR信号传导或蛋白合成来实现逆转。 图2 GSI耐药细胞系在蛋白和磷酸化修饰水平的变化 3. GSI获得性耐药模型中的分子调控特征 比较GSI敏感DND-41亲代细胞(parental cells)及其衍生的耐药细胞株(persister cells)蛋白表达差异发现,Myb、Brd4、cMyc等主调控因子在耐药细胞株中上调表达,其他上调表达的蛋白还参与活性氧清除、氧化呼吸、蛋白合成等,这些与固有耐药细胞系的情况相似。利用PDX模型筛选的耐药细胞系 (PDTALL11、PDTALL19) 也出现了相似的改变。 图3 获得性耐药细胞系的蛋白和磷酸化修饰差异 4. 激酶-底物富集分析(KSEA)找到关键的耐药调控途径 为了找到共同的调控方式,研究者利用KSEA算法分析了3种模型下GSI耐药和敏感细胞中存在的激酶-底物调控模式,结果发现Akt1、PKC家族等激酶显著富集,在耐药细胞系中十分活跃。进一步实验证实三个耐药模型中的PKCδ在蛋白水平和磷酸化水平均上调表达,且表达水平与核糖体S6蛋白磷酸化水平正相关。用PKCδ的抑制剂处理后,细胞系中S6磷酸化水平显著下调。 图4 激酶PKCδ在耐药细胞系的调控作用 5. 同时抑制Notch和PKC降低了耐药T-ALL细胞的存活率 进一步实验发现Notch通过cMyc正调控S6蛋白功能,促进细胞蛋白合成。在药物敏感细胞系中,GSI 抑制Notch活性进而下调S6蛋白;而在耐药细胞系中,PKCδ活性异常升高,促进S6蛋白的磷酸化从而解除了GSI所抑制的蛋白合成,形成细胞耐药性。作者对耐药细胞系中同时加入Notch的抑制剂GSI和PKCδ的抑制剂sotrastaurin,结果证实,联合用药显著抑制了耐药细胞的生长,并促进了耐药细胞的凋亡。这说明抑制PKCδ活性可以恢复耐药细胞对GSI的敏感性。 小编小结

实验方法简介
研究结果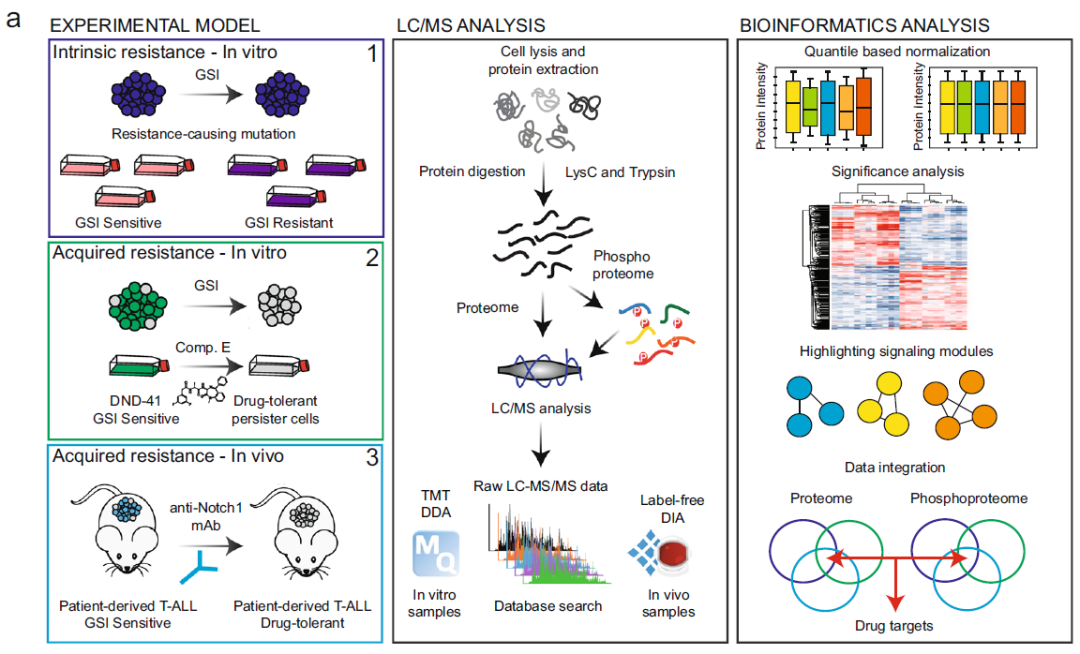
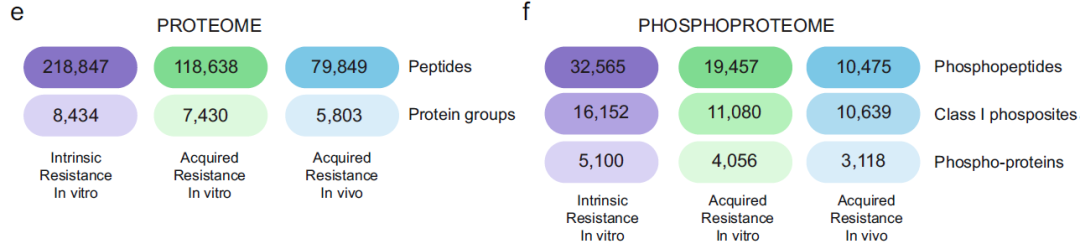
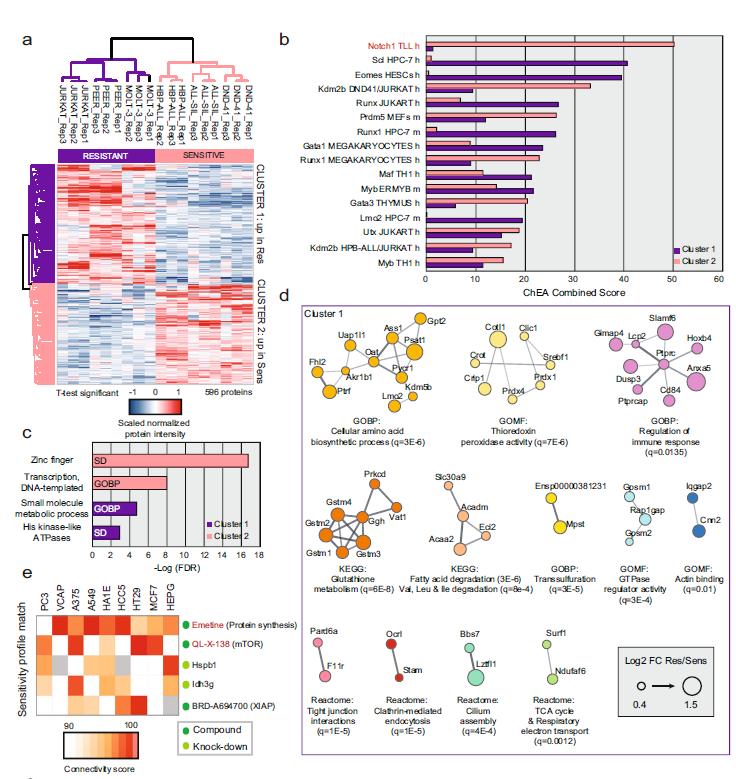
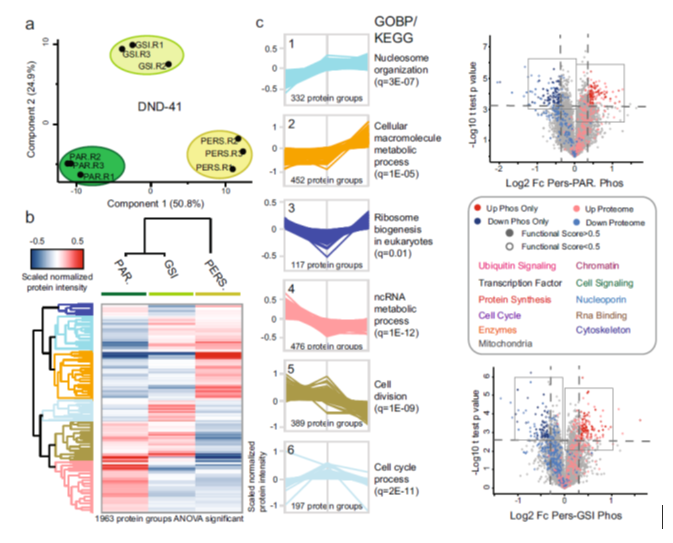
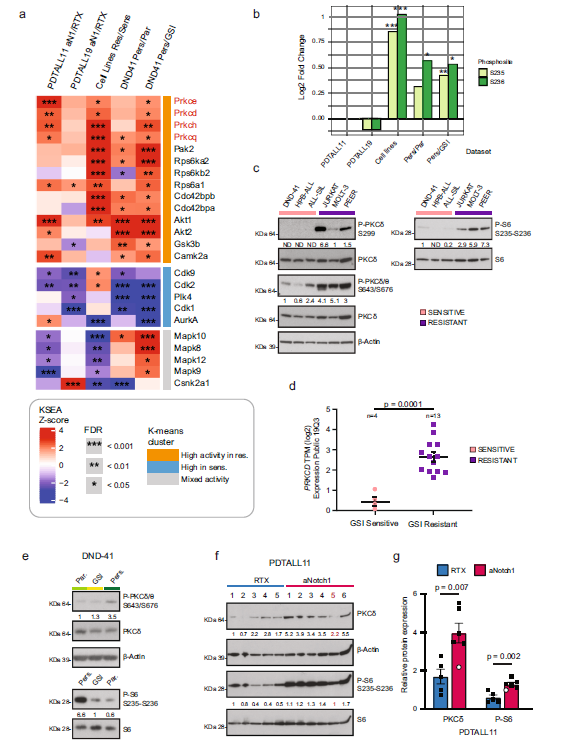
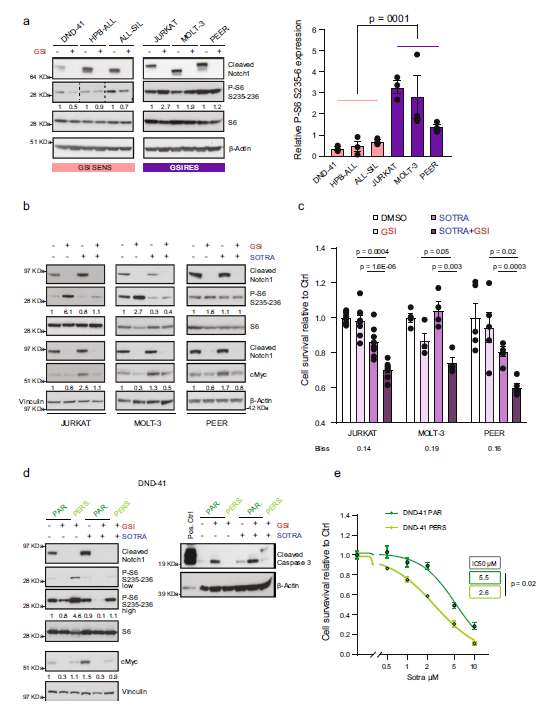
图5 Notch和PKC联合抑制效果
肿瘤治疗已经有了长足进步,针对一些关键驱动基因已经有了很好的靶向药物治疗,但肿瘤细胞对药物的耐药性是目前所面临巨大挑战。在肿瘤形成过程中可能存在固有耐药性,在治疗过程中则可能产生获得性耐药。本研究比较T-ALL肿瘤在不同条件下产生的对靶向药物GSI的耐药性模型,通过蛋白组学和DIA磷酸化修饰组学系统分析,找到了这些模型共通的耐药分子响应特征,利用激酶-底物富集分析发现了关键激酶PKCδ及其调控靶点S6核糖体蛋白,解析了耐药机制,最终发现了新的肿瘤治疗靶点和更有效的联合疗法,为克服T-ALL治疗中GSI耐药性提供了可能。
中科优品推荐
DIA磷酸化蛋白质组学具有“高覆盖度”、“高准确性”和“高稳定性”优势,对于药靶筛选、激酶分析、 植物激素调控、神经疾病等磷酸化修饰研究均可实现深度、全面的分析,无需担忧实验重复性。对于临床大队列样本的分子分型分析研究,稳定性有保障。欢迎感兴趣的老师前来咨询。
Nat Commun(IF:14.919) | 双管齐下,让癌细胞插翅难逃!DIA磷酸化助力发现T-ALL白血病新药靶
作者:上海中科新生命生物科技有限公司 2021-12-23T19:16 (访问量:3146)
上海中科新生命生物科技有限公司 商家主页
地 址: 上海市园美路58号1号楼15-18楼
联系人: 徐
电 话: 021-54665263
传 真:
Email:marketing@aptbiotech.com
相关咨询
会议邀请 | 第8届全国植物蛋白质研究大会暨首届贵阳生命科学新高地科学家论坛 (2023-07-07T14:37 浏览数:13466)
项目文章Cell(IF 64.5)| 中国科技大学探索食物过敏谜团 (2023-07-07T14:22 浏览数:13647)
Gastroenterology(IF 29.4)| 基于机器学习算法开发的外泌体miRNA生物标志物用于胰腺导管腺癌早期诊断 (2023-07-05T15:54 浏览数:11286)
Cancer Letters(IF 9.7)|天津市环湖医院利用Labelfree揭示超声-替莫唑胺联合诱导胶质瘤细胞的凋亡机制 (2023-06-30T09:37 浏览数:12329)
Excel表免费下载 | 速来围观!2023年影响因子发布 (2023-06-29T09:35 浏览数:11114)
外泌体多组学创新解决方案,精准、前沿的疾病诊断生物标志物 (2023-06-28T10:20 浏览数:15218)
Immunity (IF=43.474)丨单细胞+空间联合揭示肉芽肿形成的异常淋巴发育进程 (2023-06-26T17:28 浏览数:11422)
专家齐聚 亮点回顾 | 2023年海口·中医药创新多组学研究论坛圆满落幕 (2023-06-25T10:10 浏览数:15914)
项目文章Plant J(IF 7)| 杭州师范大学王慧中团队通过空间代谢+单细胞测序等揭示红豆杉幼茎细胞特异的紫杉烷合成调控模式 (2023-06-25T09:42 浏览数:13543)
项目文章Gut Microbes(IF 9.434)| 肠道微生物竟是导致胆囊切除术后患者腹泻的元凶? (2023-06-14T16:35 浏览数:10971)
