编者按 2021年8月25日,来自美国Wistar研究所等研究人员在Science Advances(IF:14.136)在线发表题为" A cancer ubiquitome landscape identifies metabolic reprogramming as target of Parkin tumor suppression"的研究成果。该研究通过蛋白质组学和泛素化修饰组筛选,发现了通用肿瘤抑制机制:E3泛素连接酶Parkin,可以作为肿瘤抑制途径的关键以及应激激活效应物,通过干扰癌细胞重新编程其代谢的能力来拮抗恶性细胞增殖和转移能力。 【研究材料】 PC3、LN229、MCF10A等多种癌细胞、癌组织 【技术方法】 蛋白组学、泛素化修饰蛋白组学、免疫组化、western blot等 【方法流程】 1. Parkin不影响癌细胞中的线粒体自噬 将Parkin在前列腺癌PC3细胞中过表达,未引起线粒体外膜蛋白的丢失(图1A),也未引起线粒体质量的改变(图1B)。溶酶体LAMP1蛋白与线粒体自噬时的标志蛋白TOMM20的共定位也未受PC3的影响(图1C和图1D),线粒体结构和活性也均未受影响(图1E和图1F)。 图1 Parkin不影响癌细胞中的线粒体自噬 2. Parkin抑制肿瘤细胞的运动和侵袭 Parkin在恶性胶质瘤LN229细胞中过表达减少了黏合斑的面积(图2A)、长度(图2B)及其组装和解体(图2C),抑制了肿瘤的细胞运动(图2D和图2E)。伤口闭合实验中显示Parkin抑制了细胞的定向迁移(图2F),多种癌细胞的侵袭也被Parkin阻断(图2G)。 图2 Parkin抑制肿瘤细胞的运动和侵袭 3. Parkin抑制原发性肿瘤和转移性肿瘤的生长 为了验证Parkin在肿瘤生长中的作用,作者进行了体内实验。将Parkin过表达的PC3细胞皮下接种至NOD-SCID免疫缺陷小鼠中,发现Parkin抑制了肿瘤的肺转移(图3A-3C),将PC3细胞直接接种至脾脏,结果发现Parkin也抑制了肿瘤转移至肝脏(图3D和3E)。组织芯片实验也证实肿瘤病人组织中的Parkin表达量较正常组织中少。 图3 Parkin抑制原发性肿瘤和转移性肿瘤的生长 4. Parkin抑制肿瘤细胞运动是通过其E3连接酶活性实现的 对Parkin进行点突变(S65A或C431S),使其失去E3连接酶活性,转染入前列腺癌PC3细胞中发现Parkin丢失了抑制肿瘤细胞的运动和侵袭的能力(图4A-4D)。 图4 Parkin抑制肿瘤细胞运动是通过其E3连接酶活性实现的 5. Parkin在癌症中的功能分子分析 为验证Parkin在癌症中的具体作用,作者开展了蛋白组学和泛素化修饰蛋白组学。蛋白组学实验中共鉴定到5557个蛋白,对显著性差异蛋白(Parkin过表达vs Vector)的生信分析发现Parkin影响了细胞运动通路、抑制了MAPK信号通路、下调了癌基因信号通路等通路(图5A-5D)。5557个总鉴定蛋白中的741个蛋白属于线粒体蛋白,该部分蛋白参与的呼吸链复合体(MTND1等)、内源性抗氧化、蛋白翻译等多个通路中的多个蛋白均受Parkin影响(图5E和5F)。 图5 蛋白组学和泛素化修饰蛋白组学结果 泛素化修饰组学结果中,受Parkin显著调控的泛素化蛋白主要参与了细胞死亡(如HK1蛋白)、线粒体动态变化(如MFN2、RHOT1等蛋白)、非氧化的磷酸戊糖途径(如TKT、TALDO1蛋白)等信号通路(图6A)。 Western blot实验验证了Parkin下游蛋白MFN2和TKT的泛素化水平(图6B和6C)以及Parkin对MFN2、TKT蛋白的降解和对FAK、Src的磷酸化(细胞运动所需)水平的下调(图6D和6H),且自噬抑制剂BafA不影响Parkin对MFN2和TKT的降解(图6E)。 图6 泛素化修饰蛋白组学结果及验证 6. Parkin通过调节线粒体的动态变化从而抑制肿瘤的运动 泛素化修饰蛋白组学结果中显示MFN2和RHOT1参与了线粒体动态变化信号通路,Parkin通过降解MFN2和RHOT1,从而抑制了线粒体的动态变化,在过表达Parkin的细胞中过表达MFN2则恢复了线粒体的动态变化、线粒体的融合和裂变及线粒体运动。RHOT1的过表达也发挥了与MFN2相同的作用(图7A-7F)。RHOT1点突变实验验证了Parkin是通过特异性调节线粒体的动态变化从而抑制肿瘤运动的(图7G和7H)。 图7 Parkin通过调节线粒体的动态变化抑制肿瘤运动 7. Parkin通过调节磷酸戊糖信号通路影响氧化应激从而调控肿瘤细胞的运动 泛素化修饰蛋白组学结果显示Parkin靶向了磷酸戊糖途径(PPP),作者随即验证了该信号通路对肿瘤的影响。Parkin抑制了磷酸戊糖途径中的TKT的活性(图8A),这导致了PPP通量的减少(图8B和8C)。Parkin还抑制了葡萄糖的摄入和乳酸的形成,最终导致了细胞饥饿。Parkin对TKT的抑制还降低了NADPH的水平、提高了线粒体活性氧(ROS)的增加(图8D-8F),由此产生的氧化应激可以抑制线粒体运输和肿瘤细胞运动。在Parkin过表达细胞中过表达TKT恢复了线粒体的运动(图8I)、TKT的siRNA沉默抑制了肿瘤的侵袭(图8K)以及TKT K499R的突变而未被Parkin降解进而促进了细胞迁移,上述均证明了PPP在Parkin抑制肿瘤细胞运动中的特异性。 小结 中科优品推荐 基于新一代离子淌度质谱平台,4D-修饰产品实现检测性能全面突破: 🔹 高深度——鉴定深度提升超20%~100%,挖掘更多生物信息 🔹 更微量——样本用量降低2/3,为珍贵、微量分析节省样本 🔹 更精准——精准定位相近修饰位点,提高后续位点验证概率 🔹 更可靠——金标抗体富集修饰肽段,操作可靠有保障
肿瘤作为人类健康的"头号杀手",通过重组细胞代谢适应不利微环境从而促进疾病的发展。Parkin是一种E3泛素连接酶,它可能在调节癌细胞代谢和抑制肿瘤生长方面发挥作用,但具体作用机制仍不清楚。

研究结果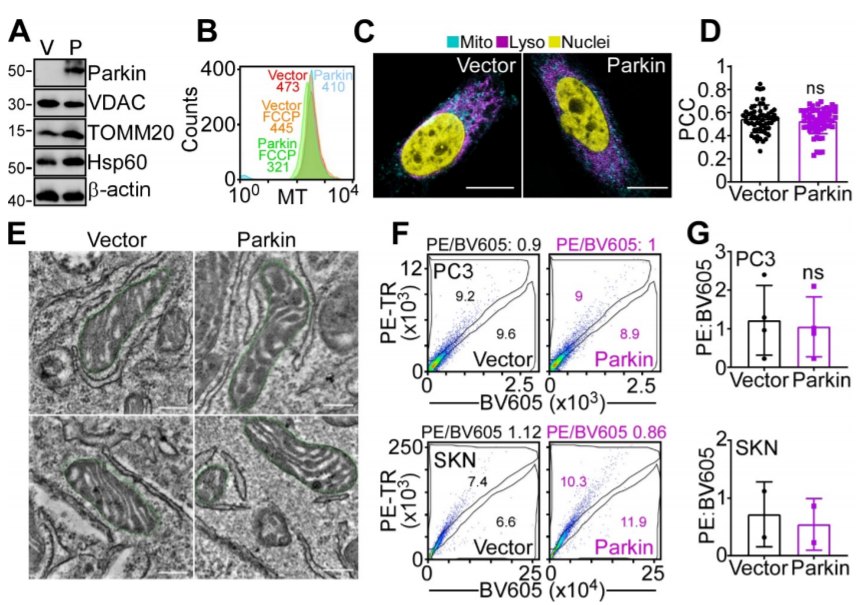
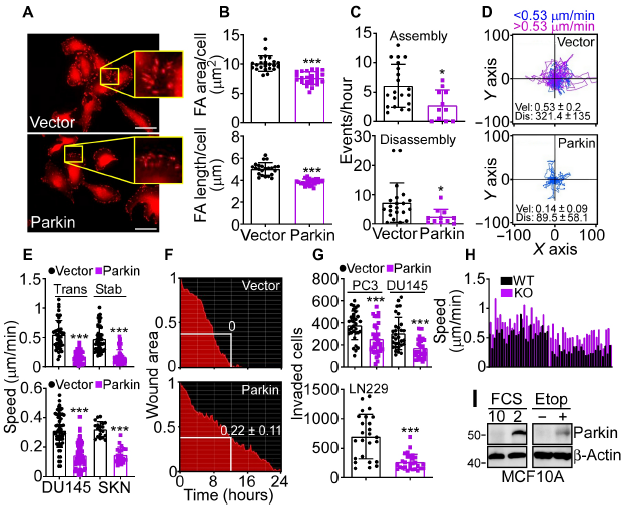
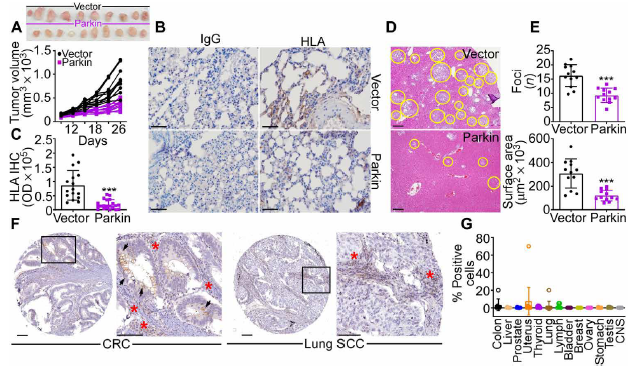
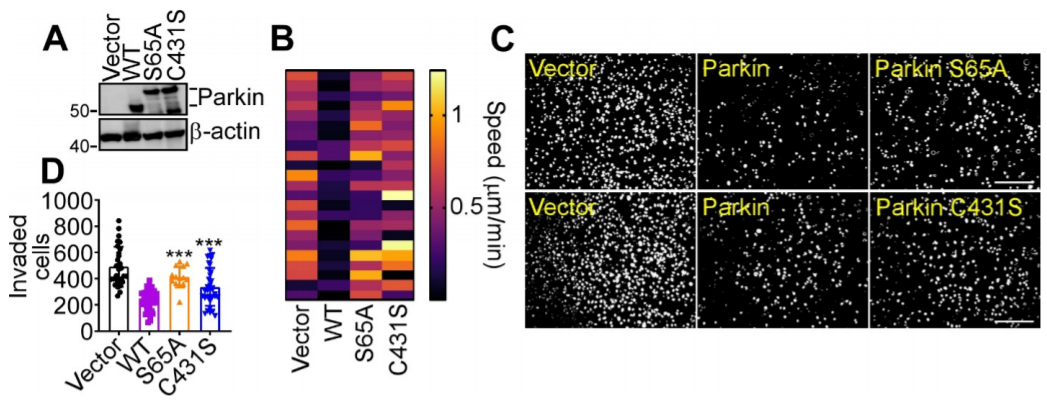
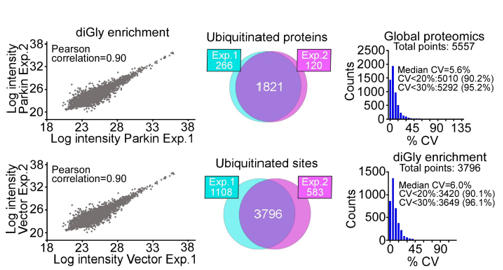
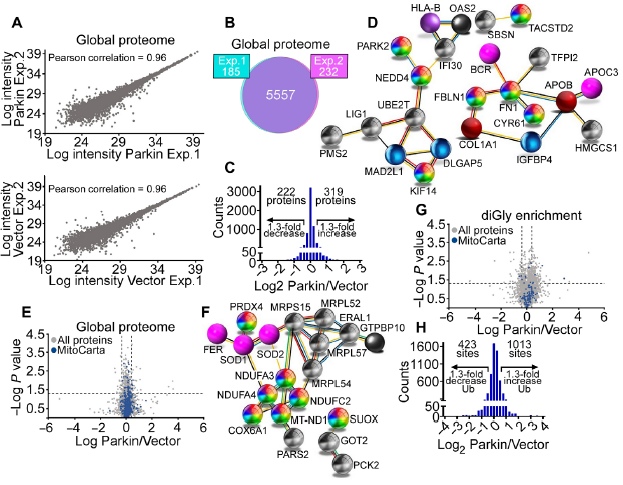
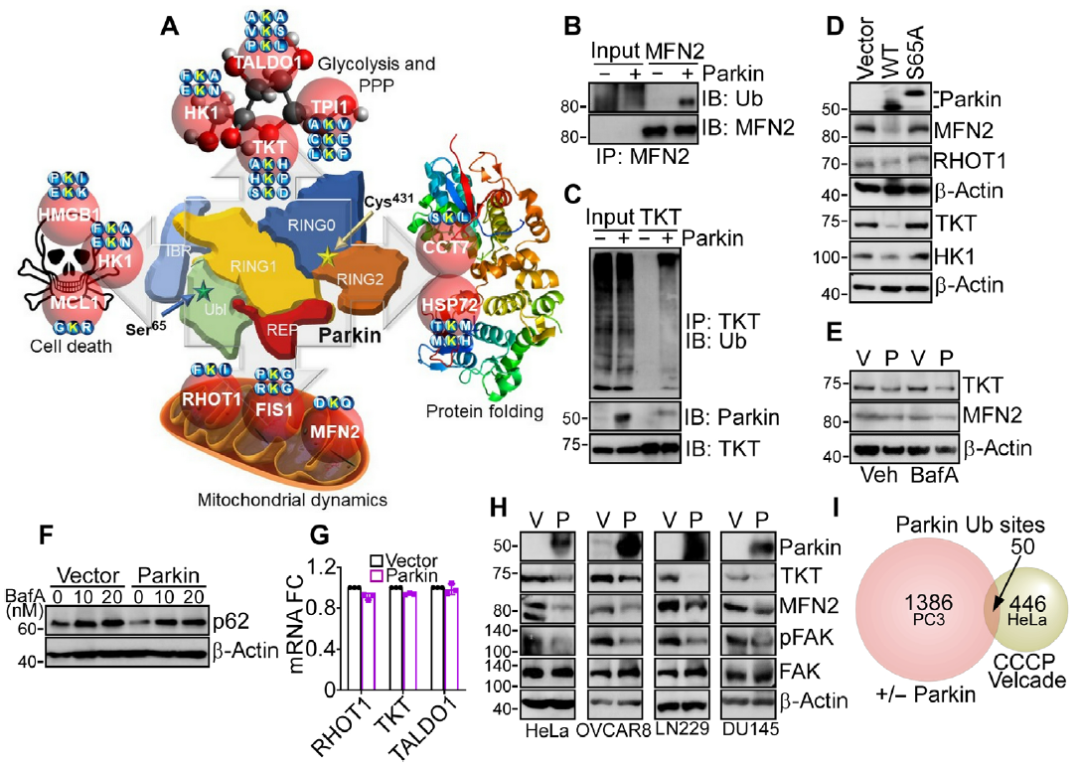
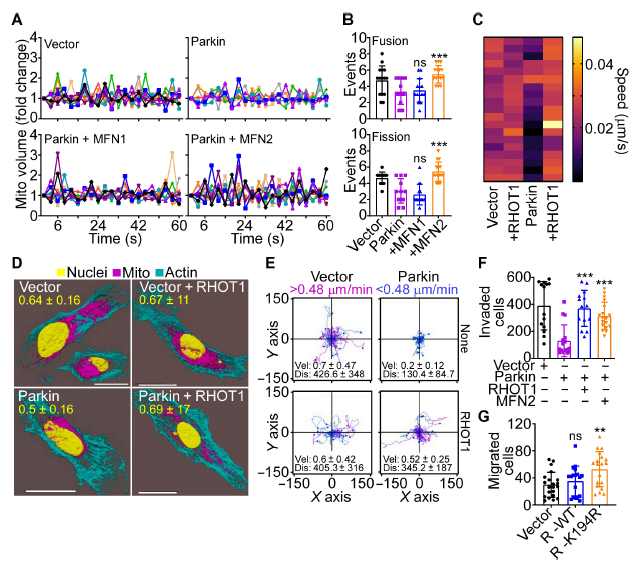
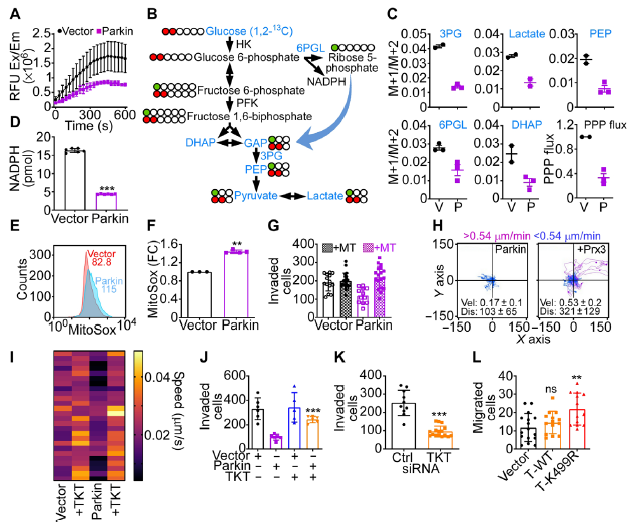
图8 Parkin通过调节磷酸戊糖信号通路调控氧化应激从而调控肿瘤细胞的运动
在这项研究中,作者证明了Parkin靶向糖酵解和线粒体网络来拮抗肿瘤生长。该途径独立于线粒体损伤或线粒体自噬激活,需要Parkin E3连接酶活性来降解线粒体动力学效应物(MFN2和RHOT1)和PPP的非氧化阶段(TKT)。这造成了急性代谢和氧化应激,抑制亚细胞线粒体运输,抑制细胞运动激酶、FAK和Src的磷酸化,并阻止肿瘤细胞运动,从而极大地抑制体内原发和转移性肿瘤的生长。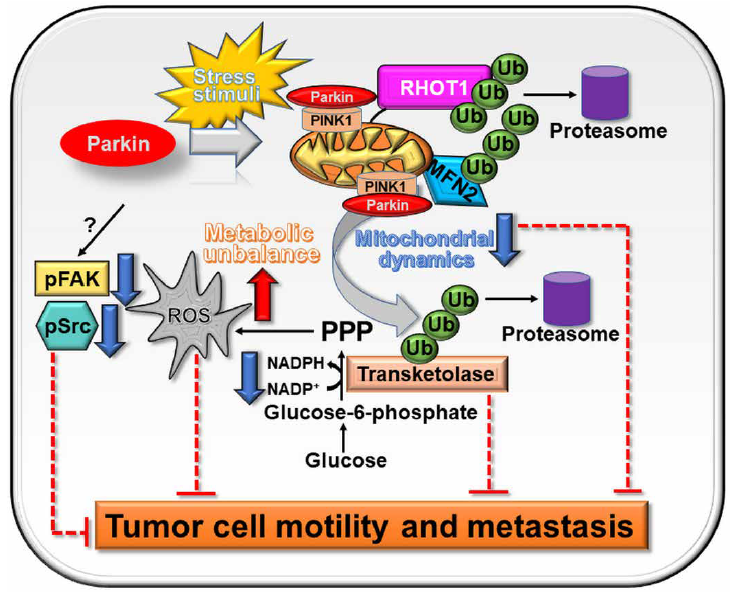
中科新生命携全新一代4D-修饰蛋白质组,开展千万级补贴优惠活动,单个样品优惠上千元。欢迎感兴趣的老师前来咨询!
Sci Adv (IF 14.136)|肿瘤“一网打尽”! 泛素化修饰组揭示广谱抑制肿瘤生长的新机制
作者:上海中科新生命生物科技有限公司 2021-12-23T19:30 (访问量:2802)
上海中科新生命生物科技有限公司 商家主页
地 址: 上海市园美路58号1号楼15-18楼
联系人: 徐
电 话: 021-54665263
传 真:
Email:marketing@aptbiotech.com
相关咨询
会议邀请 | 第8届全国植物蛋白质研究大会暨首届贵阳生命科学新高地科学家论坛 (2023-07-07T14:37 浏览数:13466)
项目文章Cell(IF 64.5)| 中国科技大学探索食物过敏谜团 (2023-07-07T14:22 浏览数:13647)
Gastroenterology(IF 29.4)| 基于机器学习算法开发的外泌体miRNA生物标志物用于胰腺导管腺癌早期诊断 (2023-07-05T15:54 浏览数:11286)
Cancer Letters(IF 9.7)|天津市环湖医院利用Labelfree揭示超声-替莫唑胺联合诱导胶质瘤细胞的凋亡机制 (2023-06-30T09:37 浏览数:12329)
Excel表免费下载 | 速来围观!2023年影响因子发布 (2023-06-29T09:35 浏览数:11114)
外泌体多组学创新解决方案,精准、前沿的疾病诊断生物标志物 (2023-06-28T10:20 浏览数:15218)
Immunity (IF=43.474)丨单细胞+空间联合揭示肉芽肿形成的异常淋巴发育进程 (2023-06-26T17:28 浏览数:11422)
专家齐聚 亮点回顾 | 2023年海口·中医药创新多组学研究论坛圆满落幕 (2023-06-25T10:10 浏览数:15914)
项目文章Plant J(IF 7)| 杭州师范大学王慧中团队通过空间代谢+单细胞测序等揭示红豆杉幼茎细胞特异的紫杉烷合成调控模式 (2023-06-25T09:42 浏览数:13543)
项目文章Gut Microbes(IF 9.434)| 肠道微生物竟是导致胆囊切除术后患者腹泻的元凶? (2023-06-14T16:35 浏览数:10972)
